Durante as reações químicas, ocorrem alterações nos corpúsculos (entidades de pequeníssimas dimensões, não são visíveis por nós a olho nú, que constituem todos os materiais existentes na Natureza - átomos, moléculas ou iões). É devido a uma reorganização dos corpúsculos reagentes, que se formam os produtos da reação.
Lembra-te que uma equação química escreve-se da seguinte forma:

Estes produtos de reação são outros corpúsculos, nos quais existem os mesmos átomos dos reagentes, mas agrupados de forma diferente.
As equações químicas, devem obedecer a uma lei muito importante, que se chama Lei de Lavoisier, ou Lei da conservação da massa.
As reações químicas representam-se, simbolicamente, através de equações químicas. No entanto estas equações químicas não são como as equações que utilizas na disciplina de Matemática! Apesar de serem parecidas em alguns aspetos.
Uma equação matemática relaciona apenas valores numéricos e incógnitas, enquanto que a equação química, contém fórmulas e símbolos químicos que dizem respeito aos reagentes e produtos de reação.
Para escrever uma equação química, é necessário seguir regras.
1 - Escreves o esquema de palavras que traduz a reação química.
2 - Escreves a(s) fórmula(s) química(s) do(s) reagente(s) e produto(s) da reação.
3 - Separas o(s) reagente(s) do(s) produto(s) de reação por meio de uma seta que indica o sentido da reação. À esquerda da seta, escreves as fórmulas químicas dos reagentes. À direita, escreves as fórmulas químicas dos produtos de reação. Os reagentes e os produtos de reação separam-se com um sinal de +
4 - Contas o número de átomos de cada elemento no(s) reagente(s) e produto(s) de reação.
5 - Multiplicas, se necessário, cada um dos reagentes e produtos de reação, por um número inteiro, de forma a que, o número total de átomos de cada espécie seja igual em cada um dos lados da equação. Observa o exemplo em baixo para perceberes melhor.
O esquema de palavras que traduz a reação entre o hidrogénio e o oxigénio, originando água, pode escrever-se da seguinte forma:
O esquema de palavras apresentado pode ser representado através dos seguintes símbolos químicos:
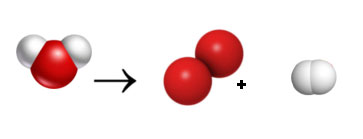
Se observares com atenção, o número de átomos não é igual dos dois lados da equação. Verifica que do lado esquerdo da equação (antes da seta) existem 3 átomos (um vermelho e dois brancos) e do lado direito existem 4 átomos (2 vermelhos e 2 brancos).
Como sabes, se no início tivermos 3 átomos, no fim não poderemos ter 4. Então, teremos que procurar uma combinação de moléculas (não se pode alterar as moléculas) de forma a que o número de átomos que exista no lado esquerdo seja igual ao que existe no lado direito.
Se acrescentarmos à equação:
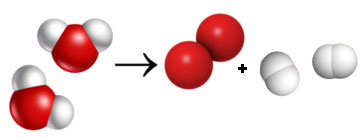
Verifica que agora o número e o tipo de átomos é igual dos dois lados. A equação já está acertada.
Vamos ver um outro exemplo.
Considera a reação de combustão do metano. A equação de palavras deve escrever-se:
A equação química será então:
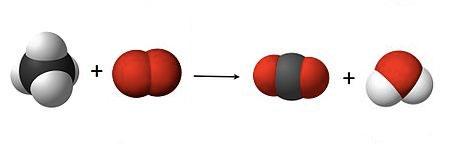
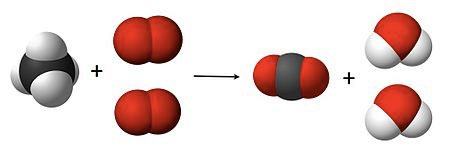
Mais uma vez se verifica que o número de átomos não é igual nos dois lados da equação. Do lado esquerdo existem 4 átomos de hidrogénio (brancos) e do lado direito apenas 2. Existem também 2 átomos de oxigénio do lado esquerdo (vermelhos) e 3 do lado direito. Assim, temos que juntar mais moléculas, até que o número de átomo se torne igual:
Como acertar ou balancear equações químicas
Uma apresentação, que através de um exemplo simples te permite perceber melhor como deves proceder para acertar (ou balancear em português brasileiro) equações químicas.
Autores: Professor Dino Duração: 5 min 15 s Fonte: Oficina do estudante, Youtube
Manual Porto Editora - "planeta azul - sustentabilidade na Terra".