Já sabes que os eletrões se encontram na nuvem eletrónica e que se movem em torno do núcleo a grande velocidade. Mas quando falamos da sua energia é possível concluir que os eletrões não só não têm todos a mesma energia como também só podem assumir determinados níveis de energia.
Por essa razão se diz que os eletrões estão distribuídos por níveis de energia.
Utiliza-se a letra n para indicar o nível de energia, em que n é um número inteiro. Atualmente n varia entre 1 e 7.
Os eletrões que estão mais próximos do núcleo possuem menor energia do que aqueles que estão mais afastados.
|
A distribuição eletrónica de um átomo é uma forma simples de representar como é que os eletrões se encontram distribuídos pelos diferentes níveis de energia. |
Os eletrões vão-se distribuir pelos diferentes níveis de energia de forma a que os átomos fiquem no seu estado mais estável (estado fundamental).
Os níveis de energia são preenchidos de forma a começar pelo nível de menor energia, e só quando este estiver completo é que se passa para o nível seguinte.
O último nível a ser preenchido nunca poderá levar mais do que oito eletrões, com exceção do primeiro nível, que só pode ser ocupado por dois eletrões.
Cada nível de energia só pode ser ocupado por um número específico de eletrões. Existe uma fórmula que nos permite calcular quantos eletrões é que podem ocupar um determinado nível de energia:
Sendo n=nível de energia => nº de eletrões = 2n2
Ou seja:
Se n=1 => nº eletrões = 2x12=2
Se n=2 => nº eletrões = 2x22=8, e assim sucessivamente.
|
O último nível de energia preenchido designa-se por nível de valência. Os eletrões que se encontram distribuídos por esse nível chamam-se eletrões de valência. |
O átomo de Flúor possui nove eletrões. Quando os distribuímos, temos de começar pelo primeiro nível. Neste nível só "cabem" dois eletrões. Os restantes são "arrumados" no segundo nível (9-2=7):
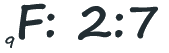
O átomo de sódio possui onze eletrões. Quando os distribuímos, ficarão dois no primeiro nível, sobrando nove. Como o segundo nível só pode levar oito, sobra ainda um que ficará no terceiro nível. Ficarão pois dois no primeiro nível, oito no segundo e um no terceiro nível, num total de onze:
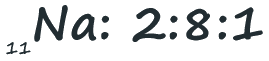
O átomo de cálcio possui 20 eletrões. O primeiro nível de energia poderá levar dois eletrões. O segundo mais oito, num total de dez. Os outros dez caberiam no terceiro nível (que pode levar até 18), mas numa das regras mencionadas acima, o último nível de energia não poderá ter mais de oito eletrões. Assim colocaremos oito no terceiro nível e os outros dois passam para o nível quatro:
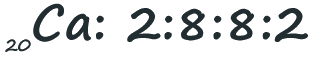
Para que possas analisar outros exemplos, apresenta-se de seguida uma tabela com as distribuições eletrónicas para os primeiros 20 átomos da tabela periódica:
| Átomo | Distribuição eletrónica | Átomo | Distribuição eletrónica |
|---|---|---|---|
| H | 1 | Na | 2 - 8 - 1 |
| He | 2 | Mg | 2 - 8 - 2 |
| Li | 2 - 1 | Al | 2 - 8 - 3 |
| Be | 2 - 2 | Si | 2 - 8 - 4 |
| B | 2 - 3 | P | 2 - 8 - 5 |
| C | 2 - 4 | S | 2 - 8 - 6 |
| N | 2 - 5 | Cl | 2 - 8 - 7 |
| O | 2 - 6 | Ar | 2 - 8 - 8 |
| F | 2 - 7 | K | 2 - 8 - 8 - 1 |
| Ne | 2 - 8 | Ca | 2 - 8 - 8 - 2 |
Podes consultar também:
Distribuição eletrónica
1. Considera o ião que se forma a partir do átomo de magnésio (Mg) sabendo que o Magnésio perde dois eletrões. O número atómico deste átomo é 12 e o seu número de massa 24.
1.1. Indica qual é a carga do ião formado.
1.2. Diz como é constituído o ião magnésio.
1.3. Qual a distribuição eletrónica do ião magnésio.
1.1. Cada eletrão possui uma carga negativa (-1). O ião formado perdeu dois eletrões, logo a sua carga será (+2).
1.2. Se o número atómico do magnésio é 12, isso quer dizer que ele tem 12 protões. Como os átomos são neutros, terá também 12 eletrões. Se o ião magnésio, quando se formou perdeu dois eletrões, então ele ficou com 10 eletrões (12-2).
O ião magnésio é constituído por: 12 protões, 10 eletrões e 12 neutrões (24-12).
1.3. A distribuição eletrónica do átomo de magnésio seria 2 - 8 - 2 pois este átomo tem 12 eletrões.
Como o ião magnésio tem apenas 10 eletrões, a distribuição eletrónica será 2 - 8.