Nem sempre o homem pensou que o átomo é como o conheces atualmente. Foi uma ideia que evoluiu ao longo dos anos. Apesar do primeiro modelo atómico ter sido apresentado já no séc. XIX, a ideia de que a matéria é feita de pequeníssimos corpúsculos surgiu há muito, muito tempo.
Na Grécia Antiga, século V a.C., o filósofo grego Leucipo e seu discípulo Demócrito imaginaram a matéria como sendo constituída por pequeníssimas partículas indivisíveis - os átomos, como lhes chamaram. Concluiram que a matéria não poderia ser infinitamente divisível. Se a partíssemos variadas vezes, chegaríamos a uma partícula muito pequena, indivisível e impenetrável a que se denominou átomo.
Esta é uma palavra de origem grega que deriva de "a + thomos" , que significa "sem divisão".
Era uma ideia muito avançada para esta altura, mas não havia possibilidade de fazer observações que a pudessem apoiar.
Só muito mais tarde, com a evolução da tecnologia é que foi possível obter evidências experimentais.
Assim, esta ideia de que os átomos seriam pequenas partículas indivisíveis perdurou durante mais de vinte séculos!
Foram vários os modelos atómicos propostos ao longo do tempo, e o modelo atualmente aceite como válido chama-se modelo da nuvem eletrónica.
Vamos então ver de seguida as características de cada um desses modelos.

John Dalton, no séc. XIX (a partir de 1803), retomou a ideia dos átomos como constituintes básicos da matéria. Para ele os átomos seriam partículas pequenas, indivisíveis e indestrutíveis. Cada elemento químico seria constituído por um tipo de átomos iguais entre si. Quando combinados, os átomos dos vários elementos formariam compostos novos.
Assim, na sequência dos seus trabalhos, concluiu que:
Os átomos que pertencem a elementos químicos diferentes, apresentam massas diferentes, assim como propriedades químicas diferentes.
Os compostos são associações de átomos de elementos químicos diferentes.
As reações químicas podem ser explicadas com base no rearranjo dos átomos, de acordo com a lei de Lavoisier.
Podes consultar também a biografia de John Dalton.
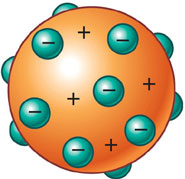
Em 1897, Thomson descobriu partículas negativas muito mais pequenas que os átomos, os eletrões, provando assim que os átomos não eram indivisíveis.
Formulou a teoria de que os átomos seriam uma esfera com carga elétrica positiva onde estariam dispersos os eletrões suficientes para que a carga total do átomo fosse nula.
Podes consultar também a biografia de Thomson.

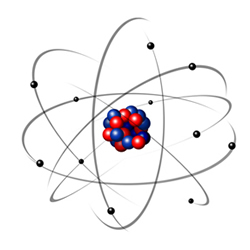
Mais tarde, em 1911, Rutherford demonstrou que a maior parte do átomo era espaço vazio, estando a carga positiva localizada no núcleo (ponto central do átomo), tendo este a maior parte da massa do átomo. Os eletrões estariam a girar em torno do núcleo.
Rutherford também descobriu a existência dos protões, as partículas com carga positiva que se encontram no núcleo.
Este Modelo não explicava porque é que os eletrões não caem no núcleo, devido à atração que apresentam pelas cargas positivas aí existentes.
Podes consultar também a biografia de Rutherford.
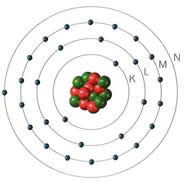
Dois anos depois, em 1913, Bohr apresentou alterações ao modelo de Rutherford:
Os eletrões só podem ocupar níveis de energia bem definidos;
Os eletrões giram em torno do núcleo em órbitas com energias diferentes.
As órbitas interiores apresentam energia mais baixa e à medida que se encontram mais afastadas do núcleo o valor da sua energia é maior.
Quando um eletrão recebe energia suficiente passa a ocupar uma órbita mais externa (com maior energia) ficando o átomo num estado excitado. Se um eletrão passar de uma órbita para uma outra mais interior liberta energia.
Os eletrões tendem a ter a menor energia possível - estado fundamental do átomo.
Podes consultar também a biografia de Bohr.

Este é o modelo atualmente aceite, tendo sido proposto na década de 1920, a par do desenvolvimento da mecânica quântica.
No núcleo (centro) do átomo estão os protões e os neutrões, enquanto que os eletrões giram em seu redor. Na figura ao lado está representada a nuvem eletrónica de um átomo. Esta nuvem representa a probabilidade de encontrar os eletrões num determinado local do espaço.
Os eletrões de um átomo ocupam determinados níveis de energia (o número de eletrões em cada nível de energia é expresso pela distribuição eletrónica).
Os principais cientistas responsáveis por esta proposta foram Heisenberg, Schrödinger e Dirac. No entanto houve também outras contribuições importantes que permitiram que chegássemos ao modelo que hoje consideramos como válido.
É de referir que a descoberta do neutrão é posterior a esta data, tendo sido provada a sua existência por James Chadwick, em 1932, apesar de já previsto por Rutherford
A evolução dos modelos atómicos
Uma apresentação que te ajuda a perceber como foi esta evolução ao longo do tempo, assim como as principais descobertas.
Autores identificados na apresentação. Apresentação adaptada para Explicatorium