Estes sólidos são constituídos por moléculas que se encontram ligadas entre si através de ligações intermoleculares. O gelo, o iodo e o enxofre são alguns exemplos de estruturas que pertencem a esta classe de sólidos.
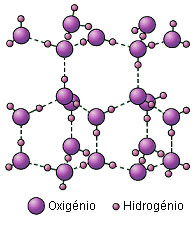
Na figura 1, onde se pode observar a estrutura do gelo, verifica-se que as ligações que se encontram indicadas a tracejado, são ligações de hidrogénio ou ligações por ponte de hidrogénio. Dentro de cada molécula, as ligações são do tipo covalente.
Os sólidos moleculares apresentam pontos de fusão e pontos de ebulição relativamente baixos, porque as ligações intermoleculares que unem as suas moléculas são relativamente frágeis, quebrando-se com alguma facilidade.
Alguns deles podem mesmo sublimar, por aquecimento, isto é, podem passar diretamente do estado sólido para o estado gasoso, como é o caso do iodo.
Também a água, quando passa ao estado sólido, ficando na forma de gelo, dá origem a um cristal molecular. Neste caso específico, forma-se uma estrutura tridimensional muito aberta, em que cada molécula de água, interactua com três outras moléculas, através de legações intermoleculares específicas, que se chamam ligações por ponte de hidrogénio ou simplesmente ligações de hidrogénio.
Quando o gelo funde, algumas destas ligações são quebradas e as moléculas aproximam-se umas das outras, ocorrendo uma diminuição de volume. É por esta razão, que o gelo é menos denso do que a água no estado líquido e por isso, o gelo flutua sobre a água, ao contrário do que geralmente acontece, em que o sólido é mais denso que o líquido.

Estas forças de coesão que unem as moléculas são relativamente frágeis. Resultam da atração entre zonas positivas e zonas negativas das moléculas.
Nos sólidos constituídos por moléculas polares, como a nuvem eletrónica não está igualmente distribuída pelos núcleos dos átomos que as constituem, origina-se a formação de polos: Um polo positivo e outro negativo. Assim cada molécula constitui um dipolo elétrico. A zona negativa de uns dipolos atrai a zona positiva de outros e assim sucessivamente. As forças de coesão entre moléculas polares são atrações entre dipolos.
Nos sólidos constituídos por moléculas apolares verifica-se que instantaneamente a sua nuvem electrónica deixa de estar distribuída uniformemente, isto é, formam-se dipolos elétricos instantâneos. A zona negativa de uns, atrai a zona positiva de outros e assim sucessivamente. As forças de coesão das moléculas apolares são atração entre dipolos instantâneos.
São pouco duros.
São muito quebradiços.
Não se deformam, nem se laminam.
Apresentam pontos de fusão e de ebulição baixos.
São maus condutores de corrente elétrica.
Manual Texto Editores - "Viver melhor na Terra".