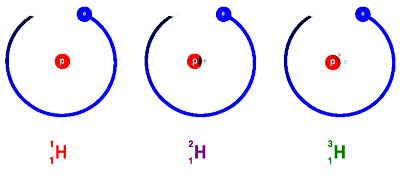
Isótopos são átomos de um elemento químico cujos núcleos têm o mesmo número atómico, ou seja, os isótopos de um certo elemento contêm o mesmo número de protões designado por "Z", mas diferentes números de massa (a massa atómica é vulgarmente designadas por "A").
São assim espécies do mesmo elemento químico, com o mesmo número atómico e diferentes números de massa. Isto é, diferem apenas no número de neutrões, sendo o número de protões e de eletrões igual.
A palavra isótopo, que significa "no mesmo lugar", advém do facto de que os isótopos se situam no mesmo lugar na tabela periódica, isto é, pertencem ao mesmo grupo e ao mesmo período. A diferença nos pesos atómicos resulta de diferenças no número de neutrões nos núcleos atómicos, ou seja, os isótopos são átomos que possuem a mesma quantidade de protões, mas não a mesma de neutrões.
Ex.: O átomo de Hidrogénio possui três formas de isótopos (ver figura acima): o Prótio (1 protão apenas) o Deutério (1 protão e 1 neutrão) e o Trítio (1 protão e 2 neutrões). No entanto, 99,9% do Hidrogénio existe na forma de Prótio.
Na nomenclatura científica, os isótopos são designados pelo nome do elemento seguido por um hífen e pelo número de nucleões - partículas que se encontram no núcleo (protões e eletrões) no núcleo atómico (ex: ferro-57, urânio-238, hélio-3). Na forma simbólica, o número de nucleões, também designado por número de massa, é escrito como um prefixo subido do símbolo químico (ex: 57Fe, 238U, 3He).
Existem 339 isótopos naturais na Terra. Mais de 3100 são conhecidos.
Podes consultar também:
Número atómico e número de massa
1. Considera os átomos representados pelas letras A a E em que as letras não representam os seus símbolos químicos.
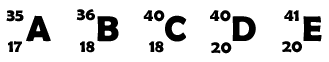
1.1. Indica o número atómico do átomo A.
1.2. Indica o número de massa do átomo B.
1.3. Indica o número de protões do átomo C.
1.4. Indica o número de eletrões do átomo D.
1.5. Indica o número de neutrões do átomo E.
1.6. Qual o valor da carga nuclear do átomo A.
1.7. Quais dos elementos apresentados são isótopos? Justifica a tua resposta.
1.1. O número atómico do átomo A é 17 (O número abaixo da letra A).
1.2. O número de massa do átomo B é 36 (O número acima da letra B).
1.3. O número de protões do átomo C é 18 (É igual ao número atómico - em baixo).
1.4. O número de eletrões do átomo D é 20 (O número de eletrões é sempre igual ao número de protões, num átomo.
1.5. O número de neutrões do átomo E é 21 (nº neutrões = nº de massa - nº atómico = 41 - 20 = 21).
1.6. A carga nuclear do átomo A é de +17 (igual ao número de protões e positiva).
1.7. Os elementos B e C são isótopos, porque o seu nº atómico é igual e o número de massa é diferente.
Os elementos D e E também são isótopos, pela mesma razão.