O número de massa de um átomo (representa-se pela letra A) é igual à soma do número de protões (Z) com o número de neutrões (N) do átomo, o que representa o número de nucleões (protões e neutrões) existentes no átomo. Assim:
Considera o seguinte exemplo:
Um átomo de carbono tem 6 protões (Z = 6).
Se ele tiver 7 neutrões (N = 7), então o seu número de massa é igual a 13, porque:
A = Z + N
A = 6 + 7
A = 13
O número de massa é representado em índice superior imediatamente antes do símbolo do átomo. Neste caso:
Átomos do mesmo elemento podem ter diferente número de neutrões. O número atómico é igual mas o número de massa pode ser diferente. Quando isto acontece esses átomos são isótopos desse elemento.
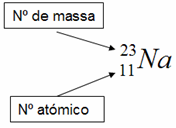
O número atómico (Z) e o número de massa (N) podem-se representar conjuntamente.
Como exemplo, vamos considerar um átomo de sódio (Na). Este elemento apresenta um número atómico 11 (Z = 11), porque tem 11 protões no seu núcleo, e um número de massa de 23 (A = 23 - significa que no seu núcleo existem 23 partículas).
Então, este seria representado da seguinte forma:
Podes consultar também:
A tabela periódica dos elementos químicos
Número atómico e número de massa
1. Indica como são constituídos cada um dos átomos X e Y, sabendo que as letras não representam os seus símbolos químicos.
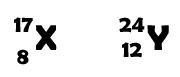
O número de protões é indicado pelo número atómico (em baixo de cada uma das letras).
O número de eletrões também é indicado pelo número atómico (num átomo nº de protões = nº eletrões).
O número de massa (em cima de cada letra) representa a soma do nº de protões com o nº de neutrões.
Assim para saber o número de neutrões, subtrai-se ao número de massa o número atómico.
Para o átomo X:
Nº de protões: 8
Nº de eletrões: 8
Nº de neutrões: 9 (17-8)
Para o átomo Y:
Nº de protões: 12
Nº de eletrões: 12
Nº de neutrões: 12 (24-12)
Manual Texto Editores - "Viver melhor na Terra".