
Dmitri Mendeleev nasceu na Sibéria e destacou-se na história da Química pois resolveu ordenar os elementos químicos então conhecidos, numa tabela, após verificar que as suas propriedades se repetiam de forma periódica.
Esta tabela de Mendeleev tinha algumas vantagens sobre outras tabelas ou teorias antes apresentadas, mostrando semelhanças numa rede de relações vertical, horizontal e diagonal. A classificação de Mendeleiev deixava ainda espaços vazios, prevendo a descoberta de novos elementos.
A tabela de Mendeleev serviu de base para a elaboração da tabela periódica atual, que além de catalogar os 118 elementos conhecidos, fornece inúmeras informações sobre o cada um deles.
Para ver a tabela original - clique aqui
Mais de metade dos elementos hoje conhecidos foram descobertos entre 1800 e 1900. Durante esse período, os químicos verificaram que certos elementos apresentavam grandes semelhanças.
A constatação da existência de regularidades periódicas nas propriedades físicas e químicas, aliada à necessidade de sistematizar toda a informação disponível, levou ao desenvolvimento da chamada Tabela Periódica dos Elementos.
Para saber mais sobre a evolução da tabela periódica - clique aqui
A tabela periódica dos elementos, na sua versão moderna apresenta o seguinte aspeto:
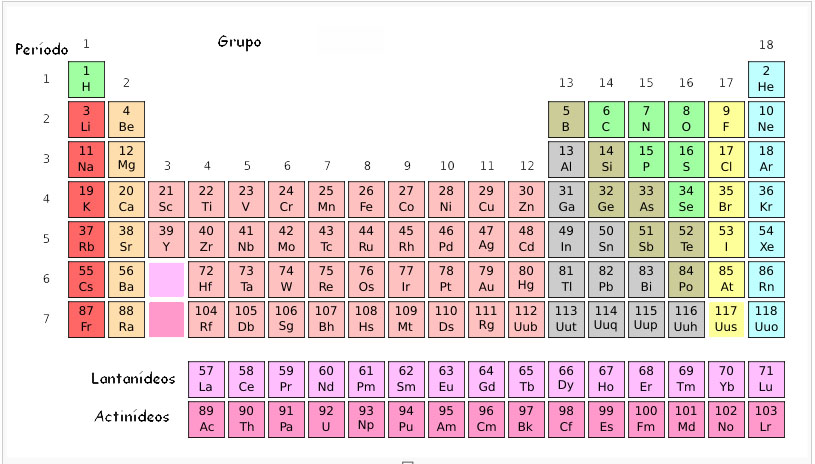
Os elementos encontram-se ordenados pelo seu número atómico (indicado nesta tabela por cima do respetivo símbolo) em sequências horizontais que se chamam períodos, e ao mesmo tempo em sequências verticais que se chamam grupos ou famílias. Alguns grupos mantêm nomes próprios, como se pode ver através da figura seguinte:
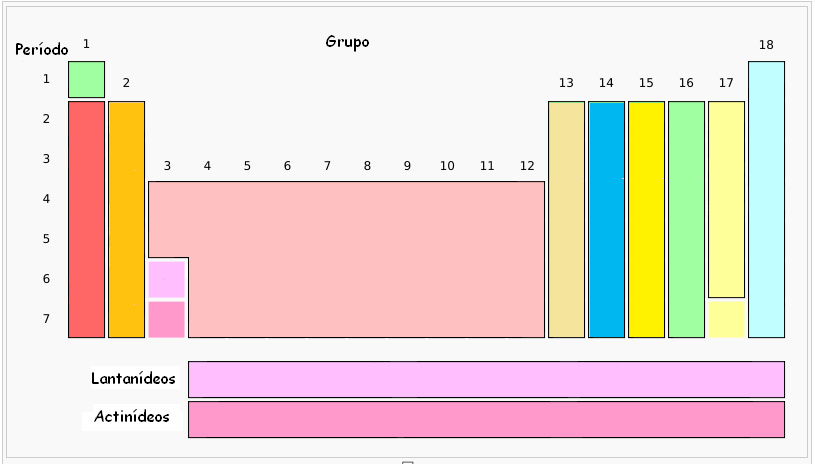
O primeiro grupo é designado por grupo dos metais alcalinos (com exceção do Hidrogénio (H)).
O segundo grupo denomina-se grupo dos metais alcalino-terrosos.
O conjunto dos grupos, entre o grupo 3 e o grupo 12 chamam-se metais de transição.
O grupo 13 é designado por família do Boro.
O grupo 14 é designado por família do Carbono.
O grupo 15 também se pode chamar família do Azoto.
O grupo 16 pode denominar-se família dos Calcogéneos.
O grupo 17 é designado usualmente por família dos Halogéneos.
O grupo 18 muito conhecido, apresenta os nomes de família dos gases raros, gases inertes ou ainda gases nobres.
As duas últimas linhas da tabela periódica são também designadas por família dos lantanídeos e família dos actinídeos, como se pode observar na primeira figura apresentada.
O primeiro período é formado por dois elementos - Hidrogénio (H) e Hélio (He).
O segundo e o terceiro períodos contêm oito elementos cada um.
O quarto e o quinto períodos contêm dezoito elementos cada um.
O sexto período contém trinta e dois elementos.
O sétimo período é atualmente constituído por trinta e dois elementos.
Bons condutores de calor e de eletricidade
Geralmente sólidos à temperatura ambiente
Propriedades intermédias entre os metais e os não-metais
Maus condutores de calor e de eletricidade
Menor uniformidade nas suas propriedades do que os metais
Na tabela periódica, dispõem-se da seguinte forma:
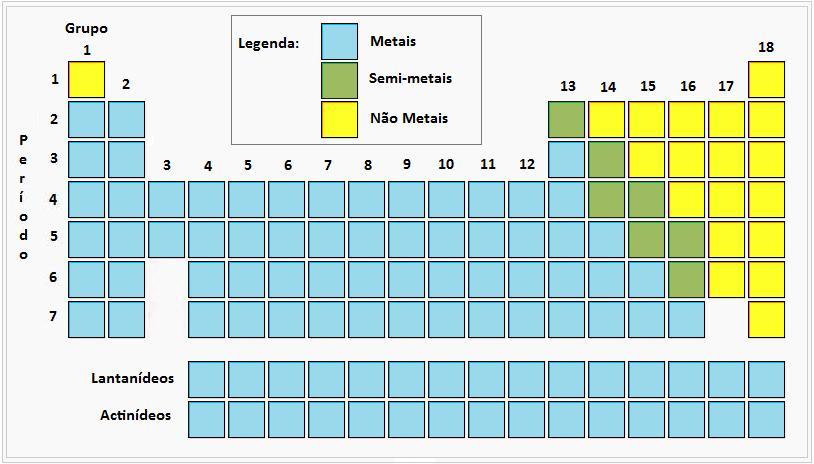
No 9º Ano estudas em particular três destes grupos da tabela periódica. Se procuras informações sobre eles, segue as ligações seguintes:
De um modo geral, o tamanho dos átomos aumenta ao longo de um grupo, à medida que o seu número atómico aumenta. Mas, o tamanho dos átomos também diminui ao longo de um período.
Os átomos dos elementos do primeiro grupo (grupo dos metais alcalinos) têm um eletrão de valência (isto é, um eletrão no último nível de energia preenchido). Por isso, têm tendência a formar iões monopositivos.
Os átomos dos elementos do segundo grupo possuem dois eletrões de valência, pelo que, originam iões dipositivos.
Os átomos dos elementos do grupo 16, apresentam seis eletrões de valência, pelo que dão origem a iões dinegativos (iões com duas cargas negativas).
Os átomos que pertencem ao grupo 17 (família dos halogéneos) têm sete eletrões de valência, pelo que originam iões mononegativos.
Os átomos que pertencem ao grupo 18, denominados gases raros, são átomos estáveis, apresentam os seus níveis de energia completamente preenchidos, e por isso não originam iões. Aparecem na natureza sob a forma de átomos isolados.
Foi criada uma página muito interessante, da responsabilidade da universidade de Nottingham, onde os autores produziram videos sobre todos os elementos da tabela periódica, mostrando imagens dos mesmos e em muitos casos falando sobre as suas aplicações.
Uma forma divertida de ficar a conhecer os elementos químicos.
Deves aceder através da seguinte ligação: Uma tabela periódica em videos
A maioria dos videos estão em inglês, mas alguns já foram legendados em português. A não perder.